어찌되었던 curing도 화학반응이니까 이에 대한 반응속도론을 알고 접근하면 정량적으로 보기 좋다.
저번 포스팅부터 자꾸 '정량적'이라는 말을 쓰고 강조하는데, 간단하게만 설명하고 넘어간다면..
무언가의 현상을 '숫자'로 나타낸다고 볼 수 있다.
예를 들면, "물가가 많이 올랐다"라고하면 많이 올랐나보다 하긴하지만, 이게 작년대비 얼마나 올랐는지 그리고 예전 경제성장기 대비 얼마나 오른것인지 등을 알 수 없다. 하지만, "물가지수가 XXX(숫자)으로 작년대비 3%올랐으며, 예전 최고로 많이 올랐던 때가 2.8%다." 라고한다면 좀 더 정확하게 알아 들을 수 있겠지?
이래서 정량적으로 표현할 수 있는 방법들을 찾는 것이다. 이를 통해 물성과의 관계를 밝혀내면, 그걸 가지고 더 좋은 방향을 빠르게 찾아갈 수 있을테니 말이다.
그래서 경화거동을 분석하는 법에 앞서 반응속도론을 간단하게만 넣었다. 자세한 내용은 반응속도론을 검색해서 공부하시면 좋겠다.
1. 반응속도론 (화학)
일단 한줄로 쉽게 설명하자면, 반응이 얼마나 빠른가를 숫자로 확인하는 방법이다. 이제부턴 미분도 나오고 하는데 어쩔수 없다 설명하려면 필요함..

A라는 물질 a mole과 B라는 물질 b mole을 넣고 반응시켰더니 C라는 물질 c mole이 나온다는 비가역 화학반응식을 가정해보자. 그러면 반응속도 v는 A의 줄어드는 속도 또는 B의 줄어드는 속도 또는 C의 생성되는 속도로 나타낼 수 있다.
식에 나와있듯이 반응속도니까 시간t가 변수로 들어간 것을 확인할 수 있다.
그럼 A, B, C중에서 측정가능한 물질하나 잡아서 줄어드는 것 또는 늘어나는 것에 대한 속도를 보면된다.
어떻게? 시간마다 정해서 반응에 영향미치지 않을정도로 조금씩 채취하여 남은양 또는 생성량을 확인하면 된다. UV로 잘보이면 그걸로하고, 적정을 해도 되고, GC/LC를 돌려도 되고 그건 반응에 따라 다양하게 시도하면 된다.

그리고 반응속도는 반응속도상수k와 반응차수 m, n으로 표현이 가능하다. 반응속도상수는 말그대로 '얼마나 빠르게'를 표현하는 계수이고, 반응차수는 반응할때 줄어드는 속도(낙차폭)가 얼마나 큰지를 보여준다. 그림으로 이해하면 더 쉬울것 같아서 그려서 표현해보았다.
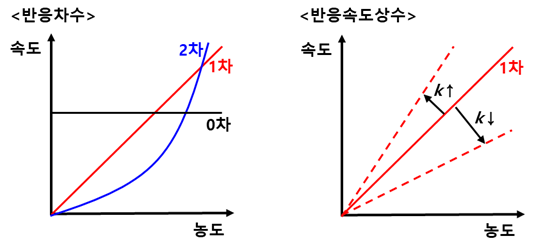
반응차수는 반응의 메커니즘과 관련되어있다. 여기서 농도는 진하게 했다는게 아니고, 반응이 지날수록 생성물의 농도가 진해짐을 표현한 것이다. 0차는 생성물이 더생기던 반응물이 줄던 반응속도는 같은 것이고, 2차반응은 생성물이 많이 생길수록 반응이 가속화 되는 것이다. k는 이 반응이 얼마나 빠르냐 느리냐의 문제로, 화학메커니즘은 같은데 촉매를 더 넣어서 속도를 빠르게 하느냐 덜 넣어서 느리게 하느냐로 보면 이해가 쉽다.
2. Kinetic study하는법
위의 반응속도론만 대강 감만 잡으면 kinetic study를 할 수 있다.
일단 숫자로만 잘 뽑아내면, 나머지 해석은 본인이 가지고 있는 화학지식을 이용하거나 논문을 찾아보면 그만이다.
그럼 순서대로 뭘 해야하는지 알아보자
1) 전환률(Conversion) 그래프 그리기
여기에는 DSC로 하는 방법을 적어둘 것이지만, 사실 어떤장비던간에 전환률만 뽑아내면 뒤에 과정은 전부 동일하다.

글로 쓰면 어려울것같아서 그림으로 표현했다. DSC에서 보는 그래프의 의미는 "이 시간에 열이 이만큼 발생했어요" 라는 뜻이다. 그리고 기계는 전기로 가열하니까 W단위로 나타나는데 이를 시간과 곱하면 J인 에너지 단위로 나온다. 즉, 빨간그래프를 적분하면 각 해당 시간의 열량이 나온다. 전환률을 구하려면 지금껏 발생한 열량을 다 더해서 총 열량으로 나누어 주면 된다. 말이 복잡하니 예를 들어 설명해주겠다.
그럼 전체 반응열이 100일때, 1초에 열량 2만큼 발생하고 2초에 4만큼 발생했다면 2초에서의 전환률은?
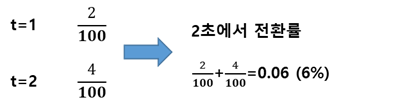
이걸로 설명이 되었으리라 본다. 다른 장비도 동일한 방법으로 계산하면되는데, 반응물이 줄어드는 것을 관찰한다면,
1-[반응물 전환률]로 하면 생성물의 전환률을 계산할 수 있다.
2) 전환률에 따른 속도증가율 그래프 그리기
음.. 여기서부터 말이 조금 복잡할 수 있는데, 잘 따라오면 다 할 수 있다. 일단 저 소제목처럼 이해도 안되는 그래프를 그리는 이유를 말해주겠다.
숫자로 표현을 하려면 있는 데이터의 규칙성을 찾아서 이를 변수화 해야 데이터를 정량적으로 표현할 수 있다.

먼저 검은색의 데이터를 정량적으로 말해 보려고 한다. 어떻게 표현할 수 있을까?
(0.2, 1.2) 이런식으로 데이터 하나하나를 다 말해야 할까?
이럴때 공학자들은 추세를 그려 데이터의 경향을 잘 설명할 수 있는 관계식을 세우고, 논리적으로 정립하여 사용한다. 그럼 빨간선처럼 1차식으로 fitting을 한다고 해보자.
빨간 직선의 특성을 가지고 데이터를 정량적으로 설명해볼까?
검은색의 데이터는 x가 증가 할수록 직선 형태로 증가하는 경향을 가진다고 말할 수 있으며, 그 정도는 0.5(기울기)이고, 시작은 x=0일때 y=1인 특성을 가지고 있다.
마찬가지로 전환률의 경향을 설명하려면, x, y평면에 올려두고 화학반응에 맞는 관계식을 가져다가 fitting하면 알 수 있다.
자, 그럼 여기서 우리가 화학반응을 숫자로 나타낼때 써야할 인자가 무엇일까?
반응속도상수 (k), 반응 차수 (m, n)
이것을 변수로 fitting하려면, 간단하게만 말하면 x가 전환률, y가 속도증가율이면 된다. 그럼 여러분들은 x컬럼과 y컬럼을 만들면 된다. x컬럼은 위에서 적분을 통해 이미 만들었고, y컬럼은 속도증가율이니 x컬럼의 전환률을 시간으로 미분하면 된다.
그래서 그래프로 표현해보면... (보통 전환률은 x를 많이 쓰니)

왼쪽변에는 독립변수(y), 오른쪽변에는 종속변수(x)로 이루어지고, 반응속도상수(k)와 반응차수(m, n)으로 이루어진 식으로 fitting을 한 결과이다. 식은 일단 autocatalytic reaction식 중 한가지를 골라서 표현하였다. 여러분이 하는 대부분의 경화반응은 이미 누군가 관계식으로 다 연구해놓았으니 내가 하는 시스템과 가장 잘 맞는 관계식을 논문에서 찾아서 쓰면 되겠다.
3. 경화거동 해석
이제는 그래프를 보고, fitting을하여 숫자를 뽑아낸 다음, 데이터를 숫자로 비교할 수 있다.
조성이나 촉매량에 따라서 반응속도가 바뀐다면, 숫자로 표현해서 촉매를 2배넣었더니 속도상수가 3배 커지더라 라는식의 정량적 표현이 가능해진다.
또는, A, B, C를 섞어서 경화하는데 A를 많이 넣으면 속도가 느려지고, B를 많이 넣으면 속도가 빨라지더라. 그리고 A를 넣을수록 빨라지지만, 점점 속도가 줄어들더라 그래서 2:1 비율이 제일 적절하더라.
C를 많이 넣었더니 반응차수가 변했는데, 자세히 봤더니 C가 A, B 물질 반응을 방해해서 경화 메커니즘이 달라졌더라 라는 식의 해석을 할 수 있다. 촉매를 개발한다면, 기존 촉매보다 반응속도가 몇배 빠르다 라는식으로 표현할 수 도 있고, 이를 통해 기울기를 '파라미터'로 하여 파라미터 특허 작성도 가능하다.
사실 경화거동 해석부분은 polyurethane 경화거동이 재밌는게 많아서 이걸 가지고 메커니즘 변화까지 포스팅하고 싶었는데, 이미 양도 너무 많고 자세히 쓴다고 이해만 어려울 것 같고 해서 패스하였다.
다음에는 Crystallization kinetics와 이에 따른 고분자 결정구조에 대해 정리하려고 한다.
'공부 > 고분자 열분석, 고분자 구조' 카테고리의 다른 글
| 고분자 결정구조 (crystal structure of polymers)를 연구하는 이유 (24) | 2021.07.02 |
|---|---|
| 활성화 에너지(Activation energy, Ea)는 뭐길래? (2) | 2021.06.30 |
| DSC: 경화거동(Curing kinetics) 1편, 경화율/경화시간 (3) | 2021.06.07 |
| DSC를 이용한 고분자 상변화 외 관찰할 수 있는것들 (2) | 2021.06.03 |
| 고분자 상변화 (DSC) (30) | 2021.03.04 |